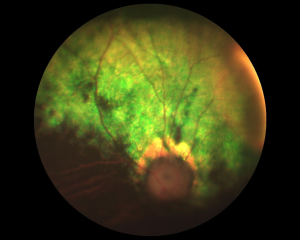
Atrophie progressive de la rétine (APR)
Ecoutez l‘épisode du podcast L’oeil au clébard pour en savoir plus sur les maladies cécitantes chez nos compagnons.
Présentation
L’atrophie progressive de la rétine (APR) est une dégénérescence héréditaire ou présumée telle des couches cellulaires externes de la rétine :
- photorécepteurs de la rétine nerveuse interne : cellules en bâtonnet ou bâtonnets sensibles aux faibles intensités lumineuses et cellules en cône ou cônes sensibles aux fortes intensités lumineuses ;
- épithélium pigmentaire rétinien externe dont l’intégrité est indispensable au métabolisme des photorécepteurs (l’atteinte des photorécepteurs est dans ce cas secondaire et le terme APR désigne au sens strict toute affection dégénérative qui intéresse directement la rétine nerveuse).
La dégénérescence évolue progressivement vers l’atrophie et vers la cécité à partir de l’âge d’un an et demi (formes précoces) jusqu’à plus de 5 ans (formes plus tardives « classiques »).
Chez le chien
Dans la majorité des formes d’APR, le fond d’œil est chronologiquement modifié comme suit: hyper-réflexion centripète progressive de la zone du tapis (ZT), plages décolorées de la zone sans tapis, migrations pigmentaires en ZT, diminution du calibre vasculaire, atrophie secondaire da la papille, disparition de la vascularisation.
La symétrie des lésions est assez constante, l’apparition de la cécité – en général d’abord nocturne – est progressive.
Une cataracte secondaire corticale postérieure équatoriale évolutive (rapidement nucléo-corticale) s’installe fréquemment lorsque l’évolution est avancée.
La cécité est exceptionnellement diurne d’emblée : chez le Malamute d’Alaska, elle s’installe entre 8 et 10 semaines d’âge.
Des lésions de rétinopathie multifocale canine (cmr, canine multifocal retinopathy) sont présentes chez de très jeunes chiens (entre 11 et 17 semaines, vers 13 semaines chez le Chien de montagne des Pyrénées). Ce sont de petits décollements séreux de la rétine et de l’épithélium pigmentaire associés à une hypertrophie de cet épithélium dans lequel s’accumule du pigment lipofuscinique.
Lors de dystrophie de l’épithélium pigmentaire (rped, retinal pigment epithelium dystrophy), les signes ophtalmoscopiques apparaissent avant les signes fonctionnels (souvent indétectables avant 4 ou 5 ans d’âge), vers 18 mois-2 ans : ils se manifestent par une pigmentation brune en mottes de la ZT, qui correspond à l’accumulation de pigment lipofuscinique dans l’épithélium pigmentaire. Ces taches augmentent en densité, se surlignent de zones hyperréfléchissantes, et des signes d’atrophie rétinienne avec hyper-réflexion diffuse et diminution du calibre vasculaire apparaissent vers 4-5 ans. L’affection est lentement progressive (au point que les sujets atteints gardent toujours pour la plupart une vision périphérique ambulatoire résiduelle).
Chez le chat
L’APR s’exprime majoritairement chez le chat par des signes fonctionnels précoces (cécité nocturne de 1,5 à 3 ans d’âge et cécité complète à partir de l’âge de 4 ans, cécité complète très précoce – quelques semaines – dans certaines formes spécifiques), alors que la majorité des formes d’APR connues dans les races canines sont d’expression plus tardive.
Une coloration grisâtre en bande naso-temporale de part et d’autre de la papille puis hyper-réflexion est souvent observé aux stades précoces dans les APR félines héréditaires. Le tapis devient ensuite grisâtre de façon diffuse puis hyperréfléchissant en plages avant disparition progressive des vaisseaux et hyperréflexion généralisée entre 2 et 5 ans.
Prédispositions raciales
Plus de 100 races canines ont été décrites comme pouvant être atteintes d’APR, les données sont moins abondantes chez le chat.
La prévalence de l’affection dans l’espèce canine varie selon la race et le type d’affection concernés : chez le Golden retriever, l’APR prcd-PRA (progressive rod cone degeneration Progressive Retinal Atrophy) est très confidentielle dans l’effectif, alors qu’une deuxième forme (GR-PRA 2, Golden Retriever – Progressive Retinal Atrophy 2) représenterait 29% des cas constatés mais que, pour 44% des chiens atteints, la mutation causale n’est pas connue.
On peut citer les races suivantes :
- Caniches nain et toy ; Chien d’eau portugais ; Cockers spaniels américain et anglais ; Retrievers du Labrador, de la baie de Chesapeake, de la Nouvelle Écosse et golden… : forme classique, progressive rod cone degeneration – Progressive Retinal Atrophy) (prcd-PRA) ;
- Husky sibérien et Samoyède : forme classique, X linked progressive retinal atrophy types 1 & 2 (XLPRA 1, XLPRA 2) ;
- Setter irlandais, Sloughi, Colley, Corgi gallois Cardigan: forme précoce, rod cone dysplasia – Progressive Retinal Atrophy (rcd-PRA) types 1, 1a, 2, 3 ;
- Schnauzer nain : forme précoce, photoreceptor dysplasia type A – Progressive Retinal Atrophy (pd type A-PRA) ;
- Chien d’élan norvégien : forme précoce, early retinal degeneration – Progressive Retinal Atrophy (erd-PRA) ;
- Teckel nain à poil long : forme précoce, cone rod dystrophy type 1 Progressive Retinal Atrophy (CORD 1-PRA) ;
Le Berger de Brie présente une forme précoce de cécité nocturne sans modification initiale du fond d’œil (congenital stationary night blindness, csnb) ;
Le Berger de Brie, le Border Collie, le Retriever du Labrador présente une dystrophie de l’épithélum pigmentaire rétinien (atrophie centrale de la rétine), retinal pigment epithelial dystrophy – Progressive Retinal Atrophy, rped-PRA (Central Progressive Retinal Atrophy, CPRA) en partie dépendante de facteurs environnementaux (vitamine E).
Certaines affections sont :
- soit moins fréquentes et très spécifiques : achromatopsie 3 (Achromatopsia-3) du Malamute d’Alaska et du Braque allemand, APR dominante (Dominant-PRA du Mastiff et du Bullmastiff ;
- soit différentes par leur clinique et leur évolution : rétinopathies multifocales (multifocal rétinopathies, MR) du Border Collie, du Lévrier Barzoï, du Retriever à poil plat… ; rétinopathie multifocale canine (canine multifocal retinopapthy, cmr type 1 -cmr1- des Mastiff, Bullmastiff, Chien de montagne des Pyrénées, Berger australien, et de type 2 -cmr 2- du Coton de Tuléar).
Chez le Chat abyssin, le Somali, l’Ocicat, une mutation ponctuelle (insertion d’un codon stop) sur CEP290 (gène codant pour une molécule impliquée dans le transport des protéines entre articles externe et interne via le cil connecteur) induit une dégénérescence précoce autosomique récessive des bâtonnets et des cônes (rdAc) Cette mutation affecterait 13% des Abyssins en Suède et 7% aux Etats-Unis, mais elle est répandue dans l’espèce féline, notamment chez 33% des Siamois, et présente chez l’American Curl, l’American Wirehair, le Bengal, le Chat de Bali et de Java, le Colourpoint, le Cornish Rex, le Munchkin, l’Oriental à poil court, le Peterbald, le Singapura, le Tonkinois.
Chez le Chat abyssin également, une dysplasie de photorécepteurs (RDy), autosomique dominante, a été décrite au Royaume Uni en 1985, responsable de mydriase et nystagmus dès l’âge de 4 semaines, avec cécité et fond d’œil totalement atrophique entre 7 semaines et un an.
Chez le Bengal, une APR précoce autosomique récessive (réponse ERG des bâtonnets éteinte à 14 semaines, des cônes à 26 semaines) est responsable d’amblyopie très nette vers l’âge de 2 ans, mais avec cet âge d’apparition est variable, elle n’est ni liée à la mutation CEP290, ni à la mutation CRX. Chez le Persan, la cause d’une dégénérescence rétinienne précoce (PRA-pd), autosomique récessive, avec nystagmus, réflexes photomoteurs diminués dès l’âge de 2-3 semaines, fond d’œil atrophique et cécité à 16 semaines ; les hétérozygotes mutés présentent des lésions de l’épithélium pigmentaire et une vision conservée
Mâles et femelles sont indifféremment atteints dans les deux espèces, sauf, dans l’espèce canine, pour XL-PRA chez le Husky et le Samoyède, où la quasi-totalité des atteints sont des femelles, ainsi que lors de rétinopathie du Border Collie et du Lévrier Barzoï.
Chez le chien comme chez le chat, à de rares exceptions près (XL-PRA, Dominant-PRA dans l’espèce canine), l’APR est transmise sur le mode autosomique récessif simple. La rped-PRA (CPRA) était décrite comme transmise sur le mode autosomique récessif ou dominant à pénétrance incomplète mais des facteurs environnementaux (carence en vitamine E) sont fortement invoqués dans son déterminisme.
Techniques diagnostiques, examens complémentaires
Il est d’abord ophtalmoscopique (ophtalmoscope indirect, lentilles 30 et 20 dioptries). Les lésions sont bilatérales et souvent symétriques. Il est étayé par le recueil de commémoratifs spécifiques (cécité nocturne puis complète, sujets apparentés affectés). L’électrorétinogramme est modifié avant que n’apparaissent les signes ophtalmoscopiques. D’autres examens complémentaires (angiographie en fluorescence, OCT) sont aussi du domaine de l’examen spécialisé. Les tests génétiques sont à employer de façon critique, en exploitant leurs avantages, en connaissant leurs limites. Un test génétique est valable à vie ; simple à réaliser (prélèvement de cellules buccales sur cytobrosse), il reconnaît trois applications : confirmer ou infirmer le diagnostic clinique, anticiper l’apparition des symptômes, dépister un type précis d’APR dans une logique d’élevage et sélection.
Traitement
Il n’existe pas de traitement. Des résultats prometteurs de thérapie génique ont été notamment enregistrés chez le Berger de Brie, le Teckel Tain à poil long, le Husky sibérien et le Samoyède, dont les affections respectives (csnb-PRA, CORD 1-PRA, XLPRA 1 & 2) sont des modèles spontanés intéressants en médecine comparée.
Dans les deux espèces, pour une maladie présumée autosomique récessive, la reproduction est déconseillée pour le sujet atteint, ses parents et descendants. Il est possible de mettre à la reproduction un sujet porteur sain hétérozygote d’APR autosomique récessive lorsque le test génétique existe pour la forme en cause, mais, dans ce cas, il est impératif de lui choisir un partenaire homozygote normal. De plus, tous les produits devront être testés car 50 % d’entre eux seront hétérozygotes et pourront transmettre la copie défectueuse du gène responsable de la maladie.